Що таке електролітична дисоціація: розбираємо явище по молекулах
Уявіть собі, що молекули у воді починають розпадатися на заряджені частинки, немов маленькі актори, які скидають маски і розкривають свою справжню природу. Це і є електролітична дисоціація — захоплюючий хімічний процес, який лежить в основі багатьох природних і технологічних явищ. Від роботи акумуляторів у вашому телефоні до смаку солоної морської води — усе це результат цього невидимого, але потужного механізму. Давайте зануримося глибше у світ іонів, розчинів і електричних зарядів, щоб зрозуміти, як і чому це відбувається.
Суть явища: як молекули стають іонами
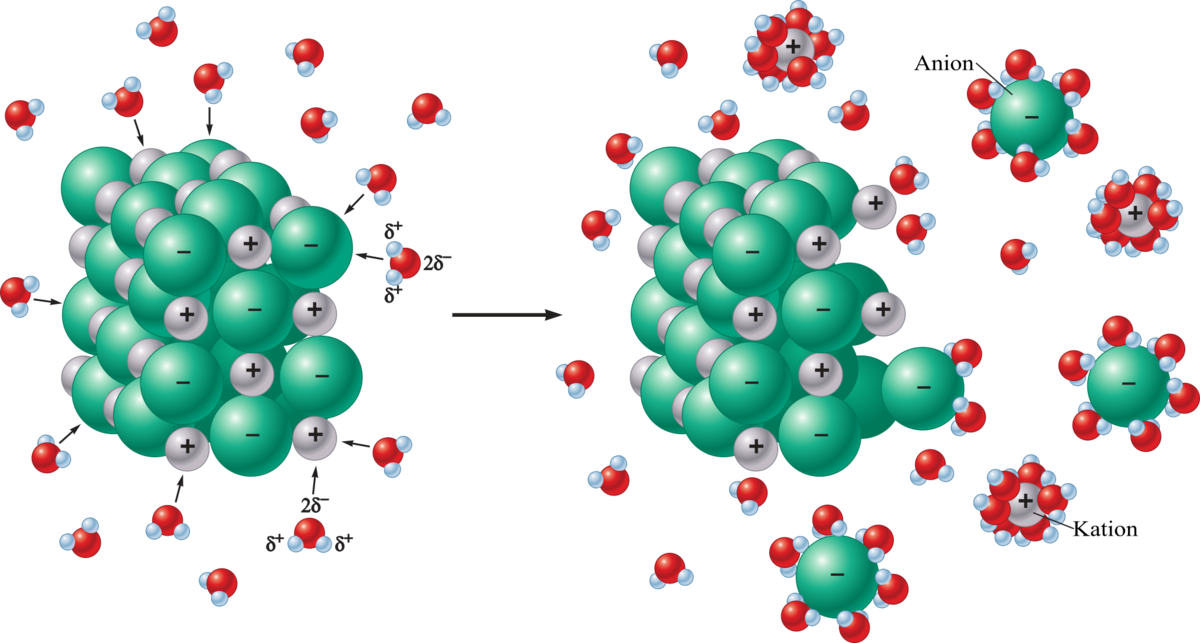
Електролітична дисоціація — це процес, під час якого молекули певних речовин, потрапляючи у воду чи інший розчинник, розпадаються на заряджені частинки, відомі як іони. Ці іони бувають позитивно зарядженими (катіони) і негативно зарядженими (аніони). Уявіть молекулу солі, яка, ніби розчиняючись у танці з водою, розпадається на натрій (Na+) і хлор (Cl-). Саме завдяки цьому розчин починає проводити електричний струм, адже іони стають носіями заряду.
Цей процес був відкритий шведським ученим Сванте Арреніусом у 1887 році. Його теорія, хоч і викликала спочатку скептицизм, стала революційною, пояснивши, чому деякі розчини проводять струм, а інші — ні. Арреніус довів, що електроліти (речовини, які дисоціюють) розпадаються на іони ще до підключення електричного поля, а не під його впливом, як вважали раніше.
Які речовини здатні до дисоціації?
Не кожна речовина може розщеплюватися на іони. Електролітична дисоціація властива лише певним класам сполук, які називаються електролітами. До них належать солі, кислоти та основи. Наприклад, кухонна сіль (NaCl), сірчана кислота (H2SO4) чи гідроксид натрію (NaOH) легко розпадаються у воді. А ось цукор чи спирт, хоч і розчиняються, іонів не утворюють — їх називають неелектролітами.
Чому так відбувається? Усе залежить від хімічної будови речовини. Електроліти мають іонний або полярний ковалентний зв’язок, який легко руйнується під впливом молекул води. Вода, до речі, сама по собі є унікальним розчинником завдяки своїй полярності — вона ніби “притягує” заряджені частинки, розриваючи зв’язки між атомами в молекулі.
Механізм процесу: що відбувається на молекулярному рівні?
Щоб зрозуміти, як працює електролітична дисоціація, уявімо собі молекулу солі, яка падає у склянку води. Молекули води, подібно до маленьких магнітів, оточують іони солі, послаблюючи зв’язки між ними. Позитивний полюс молекули води (атом водню) притягує негативний іон, а негативний полюс (атом кисню) — позитивний. У результаті молекула розпадається, і іони стають “вільними плавцями” у розчині.
Цей процес не просто красива хімічна картина — він має практичне значення. Іони в розчині рухаються хаотично, але коли до розчину підключають електричне поле (наприклад, у батареї), вони починають рухатися впорядковано: катіони до негативного електрода, а аніони — до позитивного. Так виникає електричний струм.
Ступінь дисоціації: не всі електроліти однакові
Цікаво, що не всі електроліти розпадаються на іони однаково. Деякі, як-от хлорид натрію, дисоціюють майже повністю — їх називають сильними електролітами. Інші, наприклад оцтова кислота, розпадаються лише частково, утворюючи рівновагу між іонами та нерозщепленими молекулами. Такі речовини належать до слабких електролітів.
Ступінь дисоціації залежить від природи речовини, концентрації розчину та температури. Наприклад, якщо розчин дуже розбавлений, дисоціація може відбуватися більш повно, адже молекули мають більше “простору” для розпаду. А підвищення температури часто прискорює процес, додаючи енергії молекулам.
Роль води та інших розчинників у дисоціації
Вода — справжній король розчинників, коли йдеться про електролітичну дисоціацію. Її унікальна структура, де атоми водню і кисню створюють полярність, робить її ідеальною для розщеплення іонних сполук. Але чи знали ви, що вода сама по собі є слабким електролітом? Вона частково дисоціює на іони H+ і OH-, хоча цей процес мінімальний.
Однак вода — не єдиний розчинник, здатний викликати дисоціацію. Деякі органічні рідини, як-от аміак чи диметилсульфоксид, також можуть розщеплювати електроліти, хоча й менш ефективно. Цей факт відкриває двері до експериментів у хімічних лабораторіях, де вчені шукають альтернативні середовища для реакцій.
Застосування електролітичної дисоціації: від побуту до промисловості
Електролітична дисоціація — це не просто абстрактна теорія з підручника хімії. Вона оточує нас щодня, ховаючись у найпростіших речах. Давайте розглянемо, де і як це явище працює, щоб зробити наше життя простішим і технологічно розвиненішим.
- Акумулятори та батареї. У вашому смартфоні чи електромобілі електролітична дисоціація створює струм, дозволяючи іонам рухатися між електродами. Наприклад, у свинцево-кислотних акумуляторах сірчана кислота дисоціює, забезпечуючи потік заряду.
- Очищення води. Іони, що утворюються внаслідок дисоціації, допомагають видаляти забруднення у процесі електролізу, який використовують для очищення стічних вод.
- Медицина. Фізіологічний розчин (0,9% NaCl) для крапельниць працює завдяки дисоціації солі на іони, які підтримують баланс електролітів у тілі людини.
- Промисловість. Виробництво металів, як-от алюмінію, залежить від електролізу розплавлених солей, де дисоціація відіграє ключову роль.
Ці приклади — лише верхівка айсберга. Електролітична дисоціація пронизує наше життя, від побутових дрібниць до складних технологічних процесів. А тепер уявіть, скільки ще відкриттів чекає на нас у цій сфері!
Цікаві факти про електролітичну дисоціацію
Неймовірні деталі, які вас здивують
- 🌊 Морська вода — природний електроліт. Завдяки дисоціації солей у морській воді вона проводить електричний струм, що робить її небезпечною під час грози, якщо ви перебуваєте у воді.
- ⚡ Перший акумулятор. Старовинний “Багдадський акумулятор”, створений близько 2000 років тому, ймовірно, використовував принципи електролітичної дисоціації для створення струму, хоча точне його призначення досі викликає суперечки.
- 🧪 Колір розчинів. Деякі іони, що утворюються під час дисоціації, змінюють колір розчину. Наприклад, іони міді (Cu2+) надають воді блакитного відтінку — хімічна магія на ваших очах!
- ❄️ Температурний парадокс. У дуже холодній воді дисоціація сповільнюється, але в надгарячих умовах, як у гідротермальних джерелах, вона може відбуватися ще активніше, ніж зазвичай.
Як електролітична дисоціація впливає на природу?
Природа — це величезна хімічна лабораторія, де електролітична дисоціація відіграє ключову роль. Наприклад, у ґрунті іони кальцію, магнію чи калію, що утворюються внаслідок дисоціації солей, живлять рослини, забезпечуючи їх ріст. А в океанах дисоціація солей створює унікальне середовище для морських організмів, підтримуючи їхній електролітний баланс.
Цікаво, що навіть у людському організмі цей процес є життєво важливим. Іони натрію, калію чи хлору, які утворюються завдяки дисоціації, регулюють роботу нервової системи, скорочення м’язів і навіть передачу сигналів у мозку. Виходить, що без цього явища ми б просто не могли існувати!
Порівняння сильних і слабких електролітів: таблиця
Щоб краще зрозуміти різницю між типами електролітів, давайте порівняємо їх за ключовими характеристиками у зручній таблиці.
| Характеристика | Сильні електроліти | Слабкі електроліти |
|---|---|---|
| Ступінь дисоціації | Майже 100% | Часткова (менше 10%) |
| Приклади | NaCl, H2SO4, KOH | CH3COOH, NH3 |
| Електропровідність | Висока | Низька |
Як бачите, різниця між сильними та слабкими електролітами суттєва, і вона впливає на те, як розчин поводиться в різних умовах. Це знання допомагає хімікам обирати правильні речовини для експериментів чи промислових процесів.
Майбутнє електролітичної дисоціації: що нас чекає?
Світ науки не стоїть на місці, і електролітична дисоціація залишається в центрі уваги дослідників. Уявіть батареї нового покоління, які заряджаються за лічені хвилини завдяки оптимізованим електролітам. Або технології очищення води, які використовують дисоціацію для видалення навіть найменших забруднень. У 2025 році вже ведуться експерименти з рідкими іонними розчинниками, які можуть замінити воду в певних реакціях, відкриваючи нові горизонти для хімії.
Цей процес також має значення для екології. Вчені шукають способи використовувати електроліз і дисоціацію для переробки відходів, зменшуючи забруднення планети. Хто знає, можливо, саме цей невидимий механізм допоможе нам створити чистіше і безпечніше майбутнє?